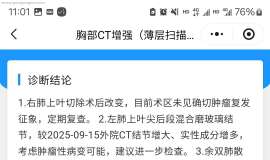
зҷҫеәҰжҗңжқҘзҡ„пјҢеҶ…е®№еӨӘеӨҡзңӢдёҚжҮӮпјҢи°ҒжқҘ科жҷ®дёҖдёӢ
3 D# ]9 I: }# e/ L3 V5 t f4 a6 P8 f& G+ m: }. _
1 йқ¶еҗ‘иӣӢзҷҪй…Әж°Ёй…ёжҝҖй…¶(tyrosine kinase)6 U+ _# l5 O& x& x8 j$ Y/ e
иӣӢзҷҪй…Әж°Ёй…ёжҝҖй…¶жҳҜдёҖзұ»е…·жңүй…Әж°Ёй…ёжҝҖй…¶жҙ»жҖ§зҡ„иӣӢзҷҪиҙЁпјҢдё»иҰҒеҲҶеёғеңЁз»ҶиғһиҶңдёҠпјҢеҸҜеҲҶдёәеҸ—дҪ“еһӢе’ҢйқһеҸ—дҪ“еһӢпјҢе…¶еҠҹиғҪйғҪжҳҜеӮ¬еҢ–ATPзҡ„зЈ·й…ёеҹәиҪ¬з§»еҲ°дёӢжёёиӣӢзҷҪзҡ„й…Әж°Ёй…ёпјҲTyrпјүж®ӢеҹәдёҠпјҢдҪҝе…¶еҸ‘з”ҹзЈ·й…ёеҢ–гҖӮиӣӢзҷҪй…Әж°Ёй…ёжҝҖй…¶жҳҜдёҖдёӘеәһеӨ§зҡ„дҪ“зі»пјҢзӣ®еүҚе·Із»ҸеҸ‘зҺ°дәҶ100еӨҡз§Қй…Әж°Ёй…ёжҝҖй…¶пјҢеҲҶеұһ20еӨҡдёӘеҸ—дҪ“й…Әж°Ёй…ёжҝҖ酶家ж—Ҹе’Ң10дёӘйқһеҸ—дҪ“й…Әж°Ёй…ёжҝҖ酶家ж—ҸгҖӮиӣӢзҷҪй…Әж°Ёй…ёжҝҖй…¶еңЁз»ҶиғһдҝЎеҸ·иҪ¬еҜјйҖҡи·ҜдёӯеҚ жҚ®дәҶеҚҒеҲҶйҮҚиҰҒзҡ„ең°дҪҚпјҢи°ғиҠӮзқҖз»Ҷиғһзҡ„з”ҹй•ҝгҖҒеҲҶеҢ–гҖҒжӯ»дәЎзӯүдёҖзі»еҲ—з”ҹзҗҶз”ҹеҢ–иҝҮзЁӢгҖӮй…Әж°Ёй…ёжҝҖй…¶зҡ„еҠҹиғҪе’ҢиӮҝзҳӨзҡ„еҸ‘з”ҹгҖҒеҸ‘еұ•еҜҶеҲҮзӣёе…іпјҢи¶…иҝҮ50пј…зҡ„еҺҹзҷҢеҹәеӣ е’ҢзҷҢеҹәеӣ дә§зү©йғҪжҳҜй…Әж°Ёй…ёжҝҖй…¶пјҢе®ғ们зҡ„ејӮеёёиЎЁиҫҫйҖҡеёёеҜјиҮҙз»Ҷиғһеўһж®–и°ғиҠӮеҸ‘з”ҹзҙҠд№ұпјҢиҮҙдҪҝиӮҝзҳӨеҸ‘з”ҹгҖӮжӯӨеӨ–пјҢй…Әж°Ёй…ёзҡ„ејӮеёёиЎЁиҫҫиҝҳдёҺиӮҝзҳӨзҡ„дҫөиўӯгҖҒиҪ¬з§»гҖҒиӮҝзҳӨж–°з”ҹиЎҖз®Ўз”ҹжҲҗд»ҘеҸҠиӮҝзҳӨзҡ„еҢ–з–—жҠ—иҚҜжҖ§еҜҶеҲҮзӣёе…ігҖӮ8 W2 d: p+ w& r" O
еҹәдәҺиҝ‘е№ҙжқҘеңЁеҹәеӣ з»„еӯҰгҖҒеҲҶеӯҗе’Ңз»Ҷиғһз”ҹзү©еӯҰд»ҘеҸҠз”ҹзү©дҝЎжҒҜеӯҰзӯүеӯҰ科еҸ–еҫ—зҡ„йҮҚеӨ§иҝӣеұ•пјҢи¶ҠжқҘи¶ҠеӨҡзҡ„й…Әж°Ёй…ёжҝҖй…¶иў«и®ӨдёәжҳҜеҫҲжңүеёҢжңӣзҡ„жҠ—иӮҝзҳӨеҲҶеӯҗйқ¶зӮ№гҖӮзӣ®еүҚжңүи¶…иҝҮ20дёӘеҲҶеұһдёҚеҗҢ家ж—Ҹзҡ„еҸ—дҪ“е’ҢйқһеҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶иў«дҪңдёәйқ¶ж ҮиҝӣиЎҢжҠ—иӮҝзҳӨиҚҜзү©зӯӣйҖүпјҢеҢ…жӢ¬иЎЁзҡ®з”ҹй•ҝеӣ еӯҗеҸ—дҪ“пјҲEGFRпјүгҖҒиЎҖз®ЎеҶ…зҡ®з»Ҷиғһз”ҹй•ҝеӣ еӯҗеҸ—дҪ“пјҲVEGFRпјүгҖҒиЎҖе°ҸжқҝиЎҚз”ҹз”ҹй•ҝеӣ еӯҗеҸ—дҪ“пјҲPDGFRпјүгҖҒжҲҗзәӨз»ҙз»Ҷиғһз”ҹй•ҝеӣ еӯҗеҸ—дҪ“пјҲFGFRпјүгҖҒиғ°еІӣзҙ еҸ—дҪ“пјҲInsRпјүгҖҒSrcгҖҒAblзӯүгҖӮйқ¶еҗ‘й…Әж°Ёй…ёжҝҖй…¶зҡ„иҚҜзү©еҲҶдёәжҠ—дҪ“зұ»е’Ңе°ҸеҲҶеӯҗжҠ‘еҲ¶еүӮгҖӮ1998е№ҙпјҢGenetechе…¬еҸёе’ҢRocheиҒ”еҗҲејҖеҸ‘зҡ„йҰ–дёӘйқ¶еҗ‘HER2/neuзҡ„дәәжәҗеҢ–еҚ•жҠ—Herceptinиў«зҫҺеӣҪйЈҹе“ҒиҚҜзү©з®ЎзҗҶеұҖпјҲFood and Drug AdministrationпјҢFDAпјүжү№еҮҶз”ЁдәҺжІ»з–—жҹҗдәӣHER2йҳіжҖ§зҡ„иҪ¬з§»жҖ§д№іи…әзҷҢгҖӮйҰ–дёӘдёҠеёӮзҡ„е°ҸеҲҶеӯҗй…Әж°Ёй…ёжҝҖй…¶жҠ‘еҲ¶еүӮжҳҜзү№ејӮйқ¶еҗ‘Bcr-Ablзҡ„GleevecпјҲNorvatisе…¬еҸёпјүпјҢе·Іе…ҲеҗҺиў«FDAжү№еҮҶз”ЁдәҺж…ўжҖ§й«“ж ·зҷҪиЎҖз—…пјҲchronic myelogenous leukemiaпјҢCMLпјүе’ҢиғғиӮ йҒ“й—ҙиҙЁзҳӨпјҲgastrointestinal stroma tumorsпјҢGISTпјүзҡ„жІ»з–—гҖӮзӣ®еүҚжңүи¶…иҝҮ100дёӘиҚҜзү©жӯЈеңЁиҝӣиЎҢдёҙеәҠз ”з©¶гҖӮ4 D, I9 M( f3 V: ^4 w! J
! N S. p' ]0 p$ z/ d/ i иҝ‘е№ҙжқҘпјҢеҲҶеӯҗйқ¶еҗ‘жҠ—иӮҝзҳӨиҚҜзү©жІ»з–—еҸҲжҸҗеҮәеҸҰдёҖдёӘжҢ‘жҲҳжҖ§жҰӮеҝөпјҡеӨҡйқ¶ж Үй…Әж°Ёй…ёжҝҖй…¶жҠ‘еҲ¶пјҲmul-tiple targeted tyrosine kinase inhibitionпјүзҡ„зӯ–з•ҘгҖӮеҹәдәҺиӮҝзҳӨеҸ‘з”ҹеҸ‘еұ•зҡ„еӨҚжқӮжҖ§пјҢз»қеӨ§йғЁеҲҶиӮҝзҳӨдёҚжҳҜдҫқйқ жҹҗдёҖжқЎдҝЎеҸ·йҖҡи·ҜжқҘз»ҙжҢҒе…¶з”ҹй•ҝе’Ңеӯҳжҙ»зҡ„пјҢдҝЎеҸ·йҖҡи·Ҝд№Ӣй—ҙеӯҳеңЁзқҖдәӨеҸүе’Ңд»ЈеҒҝгҖӮеӨҡйқ¶ж ҮиҚҜзү©еҸҜд»ҘйҖҡиҝҮжҠ‘еҲ¶еӨҡйҮҚдҝЎеҸ·йҖҡи·ҜжҲ–дёҖжқЎйҖҡи·ҜдёӯдёҠдёӢжёёзҡ„еӨҡдёӘеҲҶеӯҗиҖҢиҫҫеҲ°еҚҸеҗҢжІ»з–—гҖҒе…ӢжңҚиҖҗиҚҜзҡ„еҸҢйҮҚеҠҹиғҪгҖӮиҝҷдёҖжҰӮеҝөе·Із»ҸиҺ·еҫ—дәҶд»ӨдәәдҝЎжңҚзҡ„дёҙеәҠиҜҒжҚ®пјҢдёӨдёӘеӨҡйқ¶зӮ№е°ҸеҲҶеӯҗеҢ–еҗҲзү©sunitinibе’ҢsorafenibжңҖиҝ‘е·ІеҲҶеҲ«иў«FDAжү№еҮҶеҚ•иҚҜз”ЁдәҺиӮҫзҷҢгҖӮе…¶дёӯsunitinibеҗҢж—¶йқ¶еҗ‘VEGF-2е’ҢPDGFRгҖҒKITе’Ң FLT3зӯүеӨҡз§Қй…Әж°Ёй…ёжҝҖй…¶гҖӮиҖҢsorafenibдёҖж–№йқўйҖҡиҝҮжҠ‘еҲ¶RAF/MEK/ERKдҝЎеҸ·дј еҜјйҖҡи·ҜзӣҙжҺҘжҠ‘еҲ¶иӮҝзҳӨз”ҹй•ҝпјӣеҸҰдёҖж–№йқўйҖҡиҝҮжҠ‘еҲ¶VEGFе’ҢPDGFиҖҢйҳ»ж–ӯиӮҝзҳӨж–°з”ҹиЎҖз®Ўзҡ„еҪўжҲҗпјҢй—ҙжҺҘең°жҠ‘еҲ¶иӮҝзҳӨз»Ҷиғһзҡ„з”ҹй•ҝгҖӮеҸҰдёҖдёӘиғҪеҗҢж—¶жҠ‘еҲ¶EGFRгҖҒVEGFRе’ҢRETй…Әж°Ёй…ёжҝҖжҠ‘еҲ¶еүӮZactimaпјҲvandetanibпјүе·ІиҺ·ж¬§жҙІзҪ•и§Ғз—…иҚҜе“Ғ委е‘ҳдјҡпјҲCOMPпјүзҡ„жү№еҮҶжҺЁиҚҗпјҢз”ЁдәҺй«“з”ІзҠ¶и…әзҷҢгҖӮGleevecеңЁдёҙеәҠеә”з”ЁдёӯйҒҮеҲ°зҡ„жңҖеӨ§й—®йўҳжҳҜжҳ“дә§з”ҹиҖҗиҚҜжҖ§пјҢиҖҢ第дәҢд»Јйқ¶еҗ‘Ablе’ҢSrcжҝҖй…¶зҡ„еҸҢйҮҚжҠ‘еҲ¶еүӮеҜ№еӨ§йғЁеҲҶGleevecиҖҗиҚҜзҡ„иӮҝзҳӨйғҪжңүж•ҲгҖӮеҸҜд»Ҙйў„и§ҒпјҢеӨҡйқ¶зӮ№иҒ”еҗҲйҳ»ж–ӯдҝЎеҸ·дј еҜје°ҶжҲҗдёәжңӘжқҘй…Әж°Ёй…ёжҝҖй…¶жҠ‘еҲ¶еүӮз ”еҸ‘зҡ„ж–°зҡ„еҸ‘еұ•ж–№еҗ‘гҖӮ
2 f" A. J; \" ?) a+ `3 V# a. |3 S$ {7 U/ V; e9 Y' O
2 жҠ‘еҲ¶иӮҝзҳӨж–°з”ҹиЎҖз®Ўз”ҹжҲҗ(anti-angiogenesis)# l" m1 _; K: B+ Q1 T$ n
йқ¶еҗ‘VEGFRгҖҒFGFRгҖҒEGFRзӯүе…·жңүдҝғиҝӣиӮҝзҳӨж–°з”ҹиЎҖз®Ўз”ҹжҲҗдҪңз”Ёзҡ„еҸ—дҪ“й…Әж°Ёй…ёжҝҖй…¶жҠ‘еҲ¶еүӮд»ЈиЎЁдәҶжҠ—иӮҝзҳӨйқ¶еҗ‘иҚҜзү©з ”究дёӯеҸҰеӨ–дёҖдёӘйҮҚиҰҒж–№еҗ‘вҖ”вҖ”жҠ‘еҲ¶иӮҝзҳӨж–°з”ҹиЎҖз®Ўз”ҹжҲҗгҖӮиҮӘFolkmanеңЁ20дё–зәӘ70е№ҙд»ЈжҸҗеҮәиӮҝзҳӨж–°з”ҹиЎҖз®Ўз”ҹжҲҗзҡ„жҰӮеҝөд»ҘжқҘпјҢйқ¶еҗ‘иӮҝзҳӨж–°з”ҹиЎҖз®Ўз”ҹжҲҗзҡ„жҠ‘еҲ¶еүӮз ”з©¶е·Із»ҸеҸ–еҫ—дәҶй•ҝи¶ізҡ„иҝӣеұ•пјҢд»ҘAvastinдёәд»ЈиЎЁзҡ„иӮҝзҳӨиЎҖз®Ўж–°з”ҹжҠ‘еҲ¶еүӮеҫ—еҲ°дәҶе№ҝжіӣи®ӨеҸҜпјҢзӣ®еүҚе·ІжңүеҢ…жӢ¬жҲ‘еӣҪеңЁеҶ…зҡ„28дёӘеӣҪ家жү№еҮҶе°ҶиҜҘзұ»жҠ‘еҲ¶еүӮз”ЁдәҺиӮҝзҳӨдёҙеәҠжІ»з–—гҖӮиҝҷдәӣжҠ‘еҲ¶еүӮзҡ„з ”еҸ‘пјҢйғҪжҳҜеҹәдәҺеҜ№иӮҝзҳӨж–°з”ҹиЎҖз®Ўзҡ„з”ҹжҲҗиҝҮзЁӢзҡ„и®ӨиҜҶпјҡв‘ иӮҝзҳӨз»„з»ҮеңЁеҫҲй•ҝдёҖж®өж—¶й—ҙеӨ„дәҺдј‘зң жңҹпјҢдҫқйқ з»„з»Үжё—йҖҸз»ҙжҢҒе…¶з”ҹй•ҝгҖӮиӮҝзҳӨй•ҝеҲ°1.0пҪһ2.0 mm3ж—¶пјҢз®ҖеҚ•зҡ„жё—йҖҸдҪңз”Ёе·Із»ҸдёҚиғҪж»Ўи¶із”ҹй•ҝжүҖйңҖиҰҒзҡ„ж°§ж°”е’ҢиҗҘе…»зү©иҙЁд»ҘеҸҠд»Ји°ўзү©зҡ„жё…йҷӨпјҢзҳӨз»„з»ҮеҶ…йғЁзјәж°§пјҢзјәж°§иҜұеҜјеӣ еӯҗпјҲhypoxia inducible factorпјҢHIFпјүиЎЁиҫҫеўһејәпјӣв‘Ўеҗ„зұ»дҝғиЎҖз®Ўз”ҹй•ҝеӣ еӯҗеҰӮVEGFзӯүиЎЁиҫҫдёҠи°ғпјҢеҲәжҝҖеҶ…зҡ®з»Ҷиғһжҙ»еҢ–пјҢеҲҶжіҢиЎҖз®Ўз”ҹжҲҗжүҖйңҖзҡ„е…¶е®ғеӣ еӯҗеҰӮеҹәиҙЁйҮ‘еұһиӣӢзҷҪй…¶пјҲmatrix metalloproteinaseпјҢMMPпјүзӯүпјҢйҷҚи§Јеҹәеә•иҶңе’Ңз»ҶиғһеӨ–еҹәиҙЁпјҢеҶ…зҡ®з»Ҷиғһе‘ҲжёёзҰ»жҖҒпјӣв‘ўжёёзҰ»зҡ„еҶ…зҡ®з»Ҷиғһеҗ‘еҲәжҝҖеӣ еӯҗиҝҒ移пјҢејҖе§ӢеҪўжҲҗиЎҖз®ЎйӣҸеҪўпјӣв‘ЈеҶ…зҡ®з»ҶиғһеңЁеҲәжҝҖеӣ еӯҗдҪңз”ЁдёӢеўһж®–пјӣв‘ӨеҶ…зҡ®з»ҶиғһйҮҚж–°жҺ’еҲ—з»„еҗҲе‘ҲжқЎзҙўзҠ¶пјҢ并еҲәжҝҖжҲҗзәӨз»ҙз»ҶиғһеҲҶжіҢз»ҶиғһеӨ–еҹәиҙЁпјҢеҪўжҲҗж–°зҡ„иЎҖз®ЎгҖӮй’ҲеҜ№дёҠиҝ°иҝҮзЁӢзҡ„еҗ„дёӘзҺҜиҠӮзҡ„жҠ‘еҲ¶еүӮпјҢйғҪиғҪдёҚеҗҢзЁӢеәҰзҡ„йҳ»зўҚиӮҝзҳӨиЎҖз®Ўзҡ„ж–°з”ҹпјҢеҮҸж…ўе®һдҪ“зҳӨз»„з»Үз”ҹй•ҝйҖҹеәҰгҖӮйҷӨдәҶдёҠж–ҮжҸҗеҲ°зҡ„йқ¶еҗ‘VEGFзҡ„еҚ•жҠ—Avastinе’Ңе°ҸеҲҶеӯҗеҢ–еҗҲзү©sunitinibгҖҒsarafenibдёӨд»Јй…Әж°Ёй…ёжҝҖй…¶жҠ‘еҲ¶еүӮеӨ–пјҢеҶ…жәҗжҖ§зҡ„ж–°з”ҹиЎҖз®ЎжҠ‘еҲ¶еүӮendostatinгҖҒinterferon-ОІгҖҒ2-metho-xyestradiolгҖҒtetrahydroco-rtisolзӯүе·Із»ҸеҲҶеҲ«еңЁдёҙеәҠв…Ў/в…ўжңҹе®һйӘҢпјҢе…¶дёӯendostatinе·Із»ҸеңЁжҲ‘еӣҪдёҠеёӮгҖӮеҸҰеӨ–иҝҳжңүMMPжҠ‘еҲ¶еүӮMarimastatпјҲBB-2516пјүгҖҒAG3340гҖҒNeovastatд»ҘеҸҠжҠ‘еҲ¶еҶ…зҡ®з»Ҷиғһж•ҙеҗҲзҙ ОұvОІ3зҡ„еҚ•жҠ—Vitaxinе’Ңе°ҸеҲҶеӯҗжҠ‘еҲ¶еүӮEMD121947зӯүжӯЈеңЁиҝӣиЎҢеҗ„жңҹдёҙеәҠиҜ•йӘҢгҖӮ
0 _, E7 m. [3 N& D( O4 a5 U8 V) ?5 M; `$ C+ f' F6 J3 E1 _5 h
3 йқ¶еҗ‘з»ҶиғһеҶ…зҡ„дҝЎеҸ·иҪ¬еҜјеҲҶеӯҗ
) Q6 \' Z" }% z7 Z, v/ p( `* H з”ҹй•ҝеӣ еӯҗзӯүз»ҶиғһеӨ–з•ҢдҝЎеҸ·дёҺе…¶зү№ејӮеҸ—дҪ“з»“еҗҲдә§з”ҹзҡ„еҲәжҝҖйҖҡиҝҮеӨҡжқЎдҝЎеҸ·йҖҡи·Ҝеҗ‘з»ҶиғһеҶ…дј еҜјпјҢжһ„жҲҗдәҶз»ҶиғһеҶ…зә·з№ҒеӨҚжқӮзҡ„дҝЎеҸ·иҪ¬еҜјзі»з»ҹпјҢе…ұеҗҢи°ғжҺ§зқҖз»Ҷиғһзҡ„еўһж®–гҖҒеҲҶеҢ–гҖӮе…¶дёӯпјҢз”ұзЈ·й…Ҝй…°иӮҢйҶҮ3-жҝҖй…¶пјҲPI3Kпјүе’Ңе…¶дёӢжёёзҡ„иӣӢзҷҪжҝҖй…¶BпјҲPKB/AktпјүгҖҒйӣ·её•йңүзҙ йқ¶дҪ“иӣӢзҷҪпјҲmTORпјүз»„жҲҗзҡ„PI3K-AKT-mTORйҖҡи·ҜпјӣдёқиӢҸж°Ёй…ёиӣӢзҷҪжҝҖй…¶Rasе’ҢдёқиЈӮеҺҹжҙ»еҢ–иӣӢзҷҪжҝҖй…¶пјҲMAPKпјүдёүзә§зә§иҒ”жҝҖй…¶з»„жҲҗзҡ„Ras-MAPKйҖҡи·Ҝпјӣд»ҘеҸҠдёӢжёёдҝЎеҸ·иҪ¬еҜјдёҺиҪ¬еҪ•жҝҖжҙ»еӣ еӯҗSTAT家ж—ҸдёҺиӮҝзҳӨеҸ‘з”ҹгҖҒеҸ‘еұ•еҜҶеҲҮзӣёе…іпјҢе·Із»ҸжҲҗдёәжҠ—иӮҝзҳӨз ”з©¶зҡ„йҮҚиҰҒйқ¶зӮ№гҖӮ0 k- i% |- j c- |% |0 p
& U$ b+ _: t- x
PI3KжҳҜз”ұи„Ӯзұ»е’Ңдёқ/иӢҸж°Ёй…ёжҝҖй…¶з»„жҲҗзҡ„дёҖдёӘеәһеӨ§е®¶ж—ҸпјҢеҢ…жӢ¬ж•°дёӘзЈ·й…Ҝй…°иӮҢйҶҮжҝҖй…¶е’ҢDNAдҫқиө–зҡ„иӣӢзҷҪжҝҖй…¶еҰӮATMгҖҒATRе’ҢDNA-PKзӯүгҖӮAktжҳҜPI3KжңҖдё»иҰҒзҡ„дёӢжёёеҲҶеӯҗпјҢеүҚиҖ…еҸҜд»ҘжҝҖжҙ»еҢ…жӢ¬mTORеңЁеҶ…зҡ„еӨҡдёӘеә•зү©гҖӮmTORеҲҶеӯҗиў«жҝҖжҙ»еҗҺпјҢиғҪйҖҡиҝҮзЈ·й…ёеҢ–дёӢжёёж ёзі–иӣӢзҷҪS6жҝҖй…¶пјҲp70S6Kпјүе’Ң4EпјҚз»“еҗҲиӣӢзҷҪпјҲ4E-BPпјүеҲәжҝҖз»Ҷиғһеўһж®–гҖҒиҪ¬еҢ–并жҠ‘еҲ¶еҮӢдәЎгҖӮз ”з©¶еҸ‘зҺ°пјҢPI3K-AKT-mTORеңЁе№ҝжіӣзҡ„дәәзұ»иӮҝзҳӨи°ұдёӯеӨұи°ғпјҢиҜҘйҖҡи·Ҝдёӯжҹҗдәӣеҹәеӣ зӘҒеҸҳжүҖиҮҙзҡ„еҠҹиғҪејӮеёёжҲ–зјәеӨұдјҡеј•иө·жӯЈеёёз»ҶиғһиҪ¬еҢ–пјҢдҝғиҝӣиӮҝзҳӨз»Ҷиғһеўһж®–е’Ңеӯҳжҙ»е№¶д»ӢеҜјиӮҝзҳӨз»Ҷиғһзҡ„дҫөиўӯе’ҢиҝҒ移гҖӮеӣ жӯӨпјҢPI3K-AKT-mTORдҝЎеҸ·йҖҡи·Ҝе·Із»ҸжҲҗдёәдёҖдёӘеҫҲжңүеёҢжңӣзҡ„жҠ—иӮҝзҳӨжІ»з–—йқ¶зӮ№гҖӮдёҖдәӣе°ҸеҲҶеӯҗжҠ‘еҲ¶еүӮпјҢеҰӮйқ¶еҗ‘PI3Kзҡ„еӮ¬еҢ–дәҡеҹәp110зҡ„wortmanninгҖҒLY294002гҖҒIC484068е’ҢеӨ©з„¶жқҘжәҗзҡ„PI3KжҠ‘еҲ¶еүӮйұји—Өзҙ пјҲDeguelinпјүпјӣжҠ‘еҲ¶AktжҝҖжҙ»жүҖеҝ…йңҖзҡ„дёқ/иӢҸж°Ёй…ёжҝҖй…¶PDKзҡ„straurosporineгҖҒUCN-01е’ҢAktзҡ„жҠ‘еҲ¶еүӮperifosineпјӣд»ҘеҸҠзү№ејӮйқ¶еҗ‘mTORзҡ„жҠ‘еҲ¶еүӮйӣ·её•йңүзҙ еҸҠе…¶зұ»дјјзү©RAD001гҖҒCI779е’ҢAP23573зӯүе·Із»ҸеҲҶеҲ«иҝӣе…Ҙеҗ„жңҹдёҙеәҠз ”з©¶гҖӮзҗҶи®әдёҠжқҘи®Ійқ¶еҗ‘PI3K-AKT-mTORдҝЎеҸ·йҖҡи·Ҝзҡ„дёҠдёӢжёёдёүдёӘеҲҶеӯҗйғҪеҸҜд»Ҙжңүж•Ҳзҡ„жҠ‘еҲ¶иҜҘйҖҡи·ҜпјҢе…¶дёӯйқ¶еҗ‘дёҠжёёеҲҶеӯҗPI3KжҲ–AktжңҖжңүдјҳеҠҝпјҢдёҖж–№йқўеҸҜд»ҘйҒҝе…Қеӣ жҠ‘еҲ¶mTORеј•иө·Aktзҡ„еҸҚйҰҲжҖ§жҝҖжҙ»пјҢеҸҰдёҖж–№йқўеҸҜд»ҘеҗҢж—¶йҳ»ж–ӯAktдёӢжёёзҡ„еӨҡжқЎйҖҡи·ҜпјҢйҒҝе…ҚдёҚеҗҢдҝЎеҸ·йҖҡи·Ҝд№Ӣй—ҙзҡ„д»ЈеҒҝдҪңз”ЁгҖӮдҪҶжҳҜиҝҷдёҖзҗҶи®әдёҠзҡ„дјҳеҠҝ并没жңүеңЁдёҙеәҠиҜ•йӘҢдёӯеҫ—еҲ°иҜҒе®һпјҢеҗҢж—¶еӨҡжқЎйҖҡи·Ҝиў«йҳ»ж–ӯеҗҺдјҙйҡҸзҡ„жҜ’жҖ§й—®йўҳеҸҚиҖҢйҳ»зўҚдәҶе…¶дёҙеәҠеә”з”ЁгҖӮиҖҢзү№ејӮйқ¶еҗ‘дёӢжёёmTORеҲҶеӯҗзҡ„йӣ·её•йңүзҙ еҸҠе…¶иЎҚз”ҹзү©еңЁдёҙеәҠиҜ•йӘҢдёӯеҚҙдҪ“зҺ°еҮәиҫғеҘҪзҡ„жІ»з–—ж•ҲжһңпјҢ并жҳҫзӨәеҮәиүҜеҘҪзҡ„ејҖеҸ‘еүҚжҷҜгҖӮ- z, n: m% p7 b; j$ {
, Y9 M1 G. ]" W: J
Ras-MAPKйҖҡи·Ҝз”ұдёҖз»„зә§иҒ”жҙ»еҢ–зҡ„дёқ/иӢҸж°Ёй…ёиӣӢзҷҪжҝҖй…¶з»„жҲҗпјҢе№ҝжіӣеӯҳеңЁдәҺеҗ„з§Қз»ҶиғһдёӯпјҢдёҺPI3K/AktйҖҡи·Ҝе…ұеҗҢиӮ©иҙҹзқҖе°ҶиҶңеҸ—дҪ“дҝЎеҸ·еҗ‘з»ҶиғһеҶ…иҪ¬еҜјзҡ„д»»еҠЎпјҢеҜ№з»Ҷиғһе‘Ёжңҹзҡ„иҝҗиЎҢе’Ңеҹәеӣ иЎЁиҫҫжңүйҮҚиҰҒи°ғжҺ§дҪңз”ЁгҖӮеңЁеӨҡз§ҚиӮҝзҳӨдёӯйғҪеҸ‘зҺ°дәҶиҜҘйҖҡи·ҜиӣӢзҷҪзӘҒеҸҳеј•иө·зҡ„жҢҒз»ӯжҝҖжҙ»пјҢеңЁиӮҝзҳӨзҡ„еҸ‘з”ҹиҝҮзЁӢдёӯиө·еҲ°дәҶйҮҚиҰҒдҪңз”ЁгҖӮе…¶дёӯпјҢRasзҷҢеҹәеӣ иӣӢзҷҪдҪңдёәMAPKйҖҡи·ҜеҲҶеӯҗејҖе…іпјҢеҸҜиў«еҢ…жӢ¬EGFRгҖҒHER-2гҖҒVEGFRгҖҒPDGFRе’ҢMETзӯүеңЁеҶ…зҡ„еӨҡдёӘз»ҶиғһиҶңдёҠзҡ„й…Әж°Ёй…ёжҝҖй…¶еҸ—дҪ“жҝҖжҙ»пјҢеј•еҸ‘дёӢжёёзҡ„зә§иҒ”дҝЎеҸ·йҖҡи·ҜгҖӮеңЁеҗ„з§ҚиӮҝзҳӨдёӯRasзҡ„жҖ»зҡ„зӘҒеҸҳзҺҮеӨ§зәҰдёә30пј…пјҢжҳҜдәәзұ»иӮҝзҳӨдёӯзӘҒеҸҳзҺҮжңҖй«ҳзҡ„еҹәеӣ гҖӮ5 y( d5 Y* J) Q& R6 T
x5 }0 j, i0 s3 ]4 ^2 j i" E
RafжҳҜRasдёӢжёёжңҖйҮҚиҰҒзҡ„иӣӢзҷҪпјҢйҖҡиҝҮд»ҺиғһжөҶдёӯиҪ¬з§»еҲ°з»ҶиғһиҶңдёҠиҖҢиў«жҝҖжҙ»гҖӮRafеҚіMAPKKжҝҖй…¶пјҲMAPKKKпјүпјҢеұһдәҺдёқ/иӢҸж°Ёй…ёиӣӢзҷҪжҝҖй…¶пјҢжҳҜMAPKзә§иҒ”еҸҚеә”зҡ„第дёҖдёӘеҲҶеӯҗпјҢе®ғзҡ„зЈ·й…ёеҢ–еҗҜеҠЁдәҶMAPKзҡ„дёүзә§зә§иҒ”жҝҖжҙ»гҖӮRasгҖҒRafзҡ„зӣёз»§жҝҖжҙ»иғҪжҙ»еҢ–дёӢжёёзҡ„MEKгҖҒERKзӯүжҝҖй…¶пјҢдҝғиҝӣз»Ҷиғһзҡ„еўһж®–еҗҢж—¶иҝҳиғҪйҖҡиҝҮзЈ·й…ёеҢ–BaxгҖҒBakжҠ‘еҲ¶з»ҶиғһеҮӢдәЎгҖӮиҜҘйҖҡи·ҜеңЁиӮҝзҳӨеҸ‘з”ҹгҖҒеҸ‘еұ•дёӯзҡ„йҮҚиҰҒдҪңз”ЁдёәжҠ—иӮҝзҳӨз ”з©¶жҸҗдҫӣдәҶеӨҡдёӘжҪңеңЁзҡ„йқ¶зӮ№гҖӮзӣ®еүҚпјҢй’ҲеҜ№дёҠдёӢжёёдёҚеҗҢеҲҶеӯҗе·Із»Ҹж¶ҢзҺ°еҮәеӨҡдёӘеҸҚд№үж ёиӢ·й…ёе’Ңе°ҸеҲҶеӯҗеҢ–еҗҲзү©пјҢе…¶дёӯжңҖеј•дәәзһ©зӣ®зҡ„жңүеҪұе“ҚRasзҫ§еҹәжң«з«ҜеҠҹиғҪзҡ„жі•е°јй…°еҹәиҪ¬з§»й…¶жҠ‘еҲ¶еүӮlonafarnibгҖҒtipifarnibпјҲZarnestraпјүпјҢд»ҘеҸҠдёҠж–ҮжҸҗеҲ°sorafenibгҖӮиҜҘеҢ–еҗҲзү©жңҖеҲқиў«и®ӨдёәжҳҜRafзҡ„жҠ‘еҲ¶еүӮпјҢеҗҺжқҘеҸ‘зҺ°еҜ№еӨҡдёӘйқ¶зӮ№еҢ…жӢ¬VEGFR-2гҖҒFlt-2е’Ңc-KitзӯүйғҪжңүдҪңз”ЁгҖӮиҝҳжңүйқ¶еҗ‘дёӢжёёиӣӢзҷҪMEKзҡ„PD0325901е’ҢARRY-142886д№ҹе·Іиҝӣе…ҘдёҙеәҠз ”з©¶з”ЁдәҺй»‘иүІзҙ зҳӨз—…дәәгҖӮ
! w; k1 E, K% X9 L$ u
$ N ~; [8 q3 ~* [: [STATпјҲSignal Transducer and Activator of Transcriptionпјү家ж—ҸиӣӢзҷҪжҳҜдёҖз»„еҸҜд»Ҙиў«дёҚеҗҢзҡ„з”ҹй•ҝеӣ еӯҗеҸ—дҪ“жҝҖжҙ»зҡ„иӣӢзҷҪпјҢе°ҶдёҠжёёзҡ„дҝЎеҸ·дј йҖ’еҲ°з»Ҷиғһж ёпјҢйҖҡиҝҮиҜұеҜјйқ¶еҹәеӣ иҪ¬еҪ•иЎЁиҫҫеј•иө·дёҚеҗҢзҡ„з”ҹзү©ж•Ҳеә”пјҢ并дҝқжҢҒдҝЎеҸ·еңЁз»ҶиғһеҶ…дј йҖ’зҡ„еҶ…еңЁзү№ејӮжҖ§гҖӮеңЁеӨҡз§ҚиӮҝзҳӨз»Ҷиғһд»ҘеҸҠеҺҹдҪҚзҷҢдёӯйғҪжЈҖжөӢеҲ°дәҶSTAT家ж—ҸжҲҗе‘ҳзҡ„з»„жҲҗеһӢжҝҖжҙ»гҖӮеңЁSTAT家ж—Ҹзҡ„7дёӘжҲҗе‘ҳдёӯпјҢзӣ®еүҚеҸ‘зҺ°STAT1гҖҒSTAT3е’ҢSTAT5дёҺиӮҝзҳӨзҡ„е…ізі»жңҖдёәеҜҶеҲҮгҖӮSTAT1еҜ№иӮҝзҳӨз»Ҷиғһзҡ„еўһж®–гҖҒж–°з”ҹиЎҖз®Ўз”ҹжҲҗиө·зқҖиҙҹи°ғжҺ§зҡ„дҪңз”ЁпјҢSTAT1зјәйҷ·зҡ„е°Ҹйј жҳ“еҸ‘з”ҹиӮҝзҳӨгҖӮдёҺд№ӢзӣёеҸҚпјҢSTAT3е’ҢSTAT5зҡ„жҢҒз»ӯжҝҖжҙ»иғҪдёҠи°ғеҮӢдәЎжҠ‘еҲ¶еӣ еӯҗеҰӮBcl-2гҖҒBcl-xLгҖҒMcl-1еҸҠз»Ҷиғһе‘Ёжңҹи°ғжҺ§иӣӢзҷҪcyclins D1/D2зӯүеҹәеӣ зҡ„иЎЁиҫҫпјҢеҲәжҝҖз»Ҷиғһеўһж®–гҖҒжҠ‘еҲ¶еҮӢдәЎпјҢиў«и®ӨдёәжҳҜиҜҘ家ж—ҸдёӯжңҖжңүеёҢжңӣзҡ„жҠ—иӮҝзҳӨдҪңз”Ёйқ¶зӮ№гҖӮеңЁзҷҪиЎҖз—…гҖҒд№іи…әзҷҢгҖҒеӨҙйўҲйғЁзЈ·зҷҢзӯүеӨҡз§ҚиӮҝзҳӨдёӯйғҪеҸ‘зҺ°дәҶSTAT3зҡ„з»„жҲҗеһӢжҝҖжҙ»пјҢ并еҸ‘зҺ°STAT3зҡ„е°ҸеҲҶеӯҗжҠ‘еҲ¶еүӮжҲ–еҸҚд№үеҜЎж ёиӢ·й…ёеҸҜд»ҘйҖҶиҪ¬жҒ¶жҖ§иӮҝзҳӨзҡ„иЎЁзҺ°еһӢпјҢеўһеҠ иҖҗиҚҜзҡ„иӮҝзҳӨеҜ№еҢ–еӯҰиҚҜзү©зҡ„ж•Ҹж„ҹжҖ§гҖӮзӣ®еүҚйқ¶еҗ‘STAT家ж—Ҹзҡ„еҸҚд№үж ёиӢ·й…ёе’Ңе°ҸеҲҶеӯҗжҠ‘еҲ¶еүӮзҡ„жҠ—иӮҝзҳӨиҚҜзү©з ”еҸ‘е·Із»Ҹеј•иө·дәҶе№ҝжіӣе…іжіЁгҖӮ |